近日,中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室重要人兽共患病与烈性外来病团队在尿路致病性大肠杆菌毒力调控机制方面取得重要进展,相关研究以“Bis-molybdopterin guanine dinucleotide modulates hemolysin expression under anaerobiosis and contributes to fitness in vivo in uropathogenic Escherichia coli”为题,于2021年9月8日在线发表于微生物学权威杂志《分子微生物学(Molecular Microbiology)》上。
尿路致病性大肠杆菌(UPEC)是肠(道)外致病性大肠杆菌的一种。UPEC感染人后可导致膀胱炎、肾盂肾炎或败血症;在动物上,UPEC感染可导致禽或猪的脑部及系统感染、犬猫等的尿路感染。UPEC菌株具有多样性,编码多种毒力因子;其中,溶血素(Hemolysin)能诱导细胞死亡,与临床症状的严重性高度相关。但是,有哪些因子参与溶血素的表达和生成并不十分清楚。
本课题组前期工作发现,在低氧条件下溶血素的表达显著提高(Barbieri et al, Infection and Immunity, 2014)。基于此表型,作者利用转座子插入的方法,在约50000个突变株中筛选得到16个不同的基因参与溶血;其中的多个基因参与二-亚钼蝶呤-鸟苷二核苷钼辅因子(bis-MGD)的生物合成。钼是生物中广泛存在的过渡金属,钼辅因子通常与铁硫簇偶联,在氧化还原反应中负责电子传递,参与自然界中的碳、氮、硫代谢;而bis-MGD是钼辅因子的一种,主要整合于二甲基亚砜还原酶家族的酶中。随后,作者证实bis-MGD能够维持溶血素基因的正常转录和翻译。机制方面,作者首先通过筛选抑制性突变的方法,发现氮代谢调控蛋白NtrC是抑制溶血素表达的负调控因子。进一步的研究表明,bis-MGD的正常合成可以抑制NtrC的表达,从而解除NtrC对溶血素基因的负调控;而bis-MGD合成缺陷则可能引起无氧呼吸电子传递受阻,进而导致细菌氮代谢紊乱,激活NtrC而降低溶血素表达。这种调控机制也适用于UPEC的其它分离株,暗示其普适性。最后,作者发现bis-MGD合成缺陷导致UPEC对膀胱上皮细胞的毒性下降,以及在小鼠膀胱定殖上的降低。这些结果提示,bis-MGD的合成通路及二甲基亚砜还原酶家族有可能成为抗菌药物的靶点,用于阻碍或治疗UPEC感染。

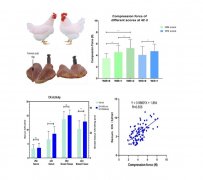
图注:bis-MGD调控溶血素表达及溶血表型. ΔmobA为bis-MGD合成缺陷株
本研究首次报道影响UPEC溶血的多个正调控及负调控因子,其中,多个因子的调控机制未知,因此为溶血素调控研究打开一片广阔天地;解析了一条未报道过的调控溶血素表达的通路;鉴定了一个UPEC的毒力相关因子。
博士生张昕杨和江西农业大学黄冬艳教授为文章的共同第一作者,蔡文通和李干武研究员为文章的通讯作者。该研究得到了国家自然科学基金青年基金(31902242)和兽医生物技术国家重点实验室自主研究课题(SKLVBP202112)的资助。