2019年10月30日,以“增强创新技术能力,拓宽行业发展方向”为主题的中国畜牧兽医学会动物药品学分会新兽药研发相关问题研讨会在郑州举行。此次会议,大咖云集,重磅信息频发,干货满满,引得三百余人参会,充分说明大家对行业发展及创新意识的关注度提升。本人就此次参会关注的几点内容做以下分享,纯属个人意见,未经与会专家审阅。
农业农村部畜牧兽医局药政药械处谷红处长做了题为《兽药行业管理政策解读》的报告,谷处的报告内容主要讲了三部分:(1)GCP;(2)192号和194号公告;(3)法规修订
GCP的目的就是围绕“研好药”展开的,确保临床试验数据真实、有效。GCP相关的法规规章和文件有《兽药管理条例》、《新兽药研制管理办法》、《兽药产品批准文号管理办法》、《兽药非临床研究质量管理规范》(2336号公告)、《兽药临床试验质量管理规范》(2337号公告)、兽药非临床研究与临床试验质量管理规范监督检查办法(2387号公告)、《兽药非临床研究质量管理规范监督检查标准》《兽药临床试验质量管理规范监督检查标准》及其监督检查相关要求(2464号公告)。自2018年1月1日起,所有申请的新兽药药理毒理及临床试验,必须在GLP和GCP单位完成,所有比对所需的生物等效、临床等效和休药期验证均需在无隶属关系的GCP单位完成。截止2019年10月31日,GCP单位共公布29家,GLP单位共公布5家,具体名单及项目如下:
兽药GCP单位29家
兽药GLP单位5家
GCP自2015年开始实施以来,政策不断变化,在监督检查中摸索前行。目前兽医局及质量监督处基本已达成共识,政策及要求愈来愈清晰。主要关键点:(一)机构资质要求。GCP单位机构应具有独立法人资格或经法人授权,不得联合申报。(二)关于人员任职和资质要求。项目负责人数量满足临床试验需求即可,项目负责人组织或参加过兽药临床试验(但不包括模拟实验),即认定其该项经历符合要求。内部各技术岗位人员的配备满足临床试验需求即可,对兼任机构不同岗位不作限制。从事临床试验的所有技术人员均应在已获得证书的CMA或者CNAS体系内的人员(并在有效期内)。(三)对于动物试验技术人员的管理。动物试验中免疫活动和现场试验记录涉及到观察、测温、采血等项目的操作应由临床试验机构技术人员完成或在上述人员监督指导下完成,其他人员可以辅助,但记录应由临床试验机构的技术人员填写。所有实验室(包括动物实验室)试验或检测均不得委托其他单位或本临床试验机构内未纳入认证认可体系的实验室完成。(四)关于临床试验机构管理。临床试验机构纳入GCP管理体系的所有实验室(包括动物实验室)均应通过CMA认证或CNAS认可。(五)关于资质要求。临床试验机构获得的CNAS实验室认可证书上的“法人”或CMA资质认定证书的“名称”内容应与《兽药临床试验质量管理规范监督检查报告表》中“单位名称”或其授权人名称一致。(六)关于租赁实验室设施设备管理。允许长期租用,租期至少2~3年,且应纳入GCP体系进行有效管理,并在已获得证书的认证认可范围内,租赁期间不得由其他单位使用。(七)关于动物试验场所。临床试验中需对试验动物开展攻毒试验的,应在临床试验机构的动物实验室开展。涉及需审批的事项,应按有关规定报批。(八)关于兽药临床试验时间问题。近5年内已完成相关临床试验项目,无论是在兽药GCP建立前后或认证认可前后完成,只要符合GCP要求,均视为符合评定标准中“完成此次申报的兽药临床试验项目1次以上”的要求。(九)关于模拟试验。原则上,已完成的兽药临床试验应为经审批或备案后开展的临床试验,否则可采用模拟临床试验方式检验兽药GCP体系运行情况。如进行模拟临床试验,一般应采用已批准上市产品按照符合兽药GCP要求的临床试验方案开展试验。兽用生物制品有效性模拟试验中应选择需要开展攻毒试验的产品进行,可选一个试验点,至少1/3注册用临床试验动物数量开展模拟试验,并应至少完成一次攻毒试验。(十)关于体外诊断制品。兽用体外诊断制品不需报告并接受兽药GCP监督检查。
二、192号公告和194号公告
192号公告公布了第二批比对目录,并对比对及一些特殊情况做了更细化和人性化的措施。比如,第二批比对目录公布了到2018年4月批准的所有新兽药,对尚在监测期内的新兽药就可以提前开展比对试验研究,但需要监测期满后方可上报。首次明确中兽药监测期满后也需要进行药学比对(从药学比对的要求来看,中兽药企业想要成功实现与原研一致的比对难度很大)。对有效期满前未进行再注册的进口兽药产品,《进口兽药注册证书》失效,但兽药质量标准继续有效;如相同品种有新的兽药国家标准,则执行新的兽药质量标准。对无法取得参比品的,原料可按照三类新兽药,制剂按照五类新兽药注册资料申请,核发兽药批准文号,不核发新兽药证书,不设监测期。对于“僵尸新兽药”,如取得《进口兽药注册证书》1年内未进口的品种,以及新兽药取得产品批准文号后1年内未生产的,其他单位可参照原料可按照三类新兽药,制剂按照五类新兽药注册资料申请,核发兽药批准文号,不核发新兽药证书,不设监测期。
194号公告明确了促生长类药物饲料添加剂退出的时间表。自2020年1月1日起,退出除中药外(山花黄芩提取物散、博落回散)所有促生长类药物饲料添加剂。自2020年7月1日起,饲料生产企业停止生产含有促生长类药物饲料添加剂的商品饲料。促生长药物饲料添加剂的退出,给替抗产品带来了市场空间。2020年7月1日前,完成“兽药添字”转“兽药字”文号变更工作。
三、关于兽药管理法规制修订重点及思路
现行的与新兽药相关的法规条例基本上是04年左右制定的,随着时代发展已经不能满足现行新兽药的相关研发需求和趋势。所以兽医局已着手对《兽药管理条例》(2004年)、《兽药生产质量管理规范》(2002年)、《新兽药研制管理办法》(2005年)、《兽药注册办法》(2004年)、《兽药注册资料要求》(2004年)、《兽用生物制品经营管理办法》(2007年)进行制修订,目前相关工作已着手启动。正在研究制修订的包括:兽药标准管理办法(国家标准+注册标准)、兽用生物制品批签发管理办法、兽药委托生产管理办法、兽药出口、网络销售管理有关规定。预计近期会发布《兽药管理条例》修订征求意见稿,《兽药生产质量管理规范》正式稿。积极推进新兽药研制管理办法、兽药注册办法及兽药注册资料要求,此次制修订属于自上而下的全方位修订,估计持续周期在3-5年左右。
《兽药管理条例修订重点》:(1)完善兽药定义,科学定义假劣兽药;(2)实施注册制,取消兽药产品批准文号有效期;(3)完善兽药标准体系(国家标准、企业注册标准);(4)增加委托生产、网络销售、兽药追溯等内容;(5)严格监管措施,加大处罚力度。
《兽药生产质量管理规范修订主要变化》:(1)提高了无菌兽药和兽用生物制品的生产标准:将无菌兽药和兽用生物制品设置为A/B/C/D4个级别,增加了生产环境在线监测要求;(2)提高了特殊兽药品种生产设施要求:独立建筑物(消毒剂和杀虫剂)或独立生产车间;(3)提高并细化了软件管理要求;(4)提高了从业人员的素质和技能要求;(5)提高了文件管理要求。
《新兽药研制管理办法》《兽药注册办法》以及《兽药注册资料要求》的修订:(1)严格新药定义,解决新药不新问题。新药不再分一、二、三类。诊断制品不再核发新兽药证书,直接核准标准、发放产品批准文号(近期会公布实施);(2)完善兽药注册规定,确保新产品安全、有效、质量可控;细化注册资料技术要求,提高可操作性,避免理解误差,最大程度控制自由裁量权;(3)根据不同产品特性,资料要求科学做好加减法;增加水产养殖用、宠物用兽药等注册资料要求;
(4)增加补充注册,生产工艺变更:注册、备案或报告;(5)加强现场核查、送样改为现场抽样,确保研究数据真实、样品真实;(6)强化惩处,严厉打击数据或资料等造假行为;(7)引导、促进真正的技术转让和转化,真正实现上下游技术、产学研一体化。
中国兽医药品监察所化药评审处董义春处长做了题为《兽药评审新标准新措施介绍》的报告。董处的报告内容主要包括四部分:(1)网上评审系统介绍;(2)评审中的沟通交流工作;(3)临床试验备案问题;(4)评审标准问题。
一、
网上申报系统
网上评审的法规依据是农业部公告第2599号。自2018年11月1日启动兽药评审系统(农业农村部公告第75号)。网上评审主要包括网上申报、网上评审、网上沟通交流和数据库四个模块。目前网上申报是对于已经通过形式审查的产品,需要提交网上申报,申报时要注意电子版材料务必与纸质资料内容完全一致。目前兽药评审系统与部行政审批系统还未统一,还需2次分开填报,待部里打通系统以后,只需提交一次即可。填报的材料经随机选取相关领域专家,进行网上评审,评审时限为10个工作日,截止2019年8月底,已网上评审中化药品种127个,生药品种132个。网上评审的重大突破就是有了网上沟通交流机制:包括评审中的共性问题、资料库数据查阅、特定问题解答(申报产品、申报单位一对一)。
二、
评审中的沟通交流工作
(1)网上交流。无评审系统账号的,可以登录中国兽药信息网,查看针对一些共性问题的解答;对有兽药评审系统账号的,可以查询共性问题和特定问题交流。(2)会议交流。取消第一次初审时介绍情况的环节,从第二次初审直到复审,如对评审意见有需要解释的,均可向评审中心办公室提取在评审会上解释说明的申请。对退审产品,申报单位有权利申诉,通常情况下安排下次评审会议审议。(3)咨询日交流。特定时间(每周固定一天),需要提前申请,针对正在评审的品种,有面对面交流需要的。有些能当场给出答复,有些需要研究后答复,甚至咨询专家意见后答复。(4)电话交流。简单问题、紧急问题、程序性问题。双方均有电话记录,一般能电话咨询的问题,都是小问题,建议从各方渠道查询。(5)信函交流。目前应用较少,只针对退审回函无申诉意见使用。
三、
临床试验备案问题
依据农办牧[2019]30号文件,新兽药开展临床试验前均需备案。备案表上要有备案单位意见及公章,备案表可以邮寄,也可专人送达。备案表送达后评审中心即进行封存。待新兽药注册资料提报后,再开封,一一对应备案试验方案和注册资料试验报告结果(时间、内容等是否与方案一致)。所有试验均需备案。试验方案发生修改的,也需要重新备案报送评审中心。
四、
目的是为统一评审标准、提升评审尺度的一致性、减少人为判断的误差,践行“依法、科学、公正、高效”的评审理念。目前已制定实施五个评审标准。《兽用化学药品药学研究评审技术标准(试行)》《兽用中药、天然药物药学研究评审技术标准(试行)》(农牧便函【2017】1019号)《兽用化学药物临床药代动力学试验资料评审技术标准(试行)》、《兽用化学药品生物等效试验资料评审技术标准(试行)》、《兽用中药、天然药物药理毒理与临床研究评审技术标准(试行)》(农牧便函【2018】395号)。虽然这些评审标准实际是给评审专家看的,掌握评审尺度。但个人感觉更值得所有研发人员细致研究,严格按照442公告和相关指导原则,结合现有评审技术标准,来提升新兽药研发的成功率!
从谷处和董处的报告中可以看出,兽药相关法规的制修订及新兽药评审新举措借鉴了欧盟、FDA及人药的很多政策和思路,使得兽药研发和生产更加科学和高效。促进了行业的进步和发展,需要各位同仁以乐观的心态,积极应对和拥抱行业的进步和变化,真正开发安全、有效、质量可控的“新兽药”!关于新兽药研发相关问题研讨会其他专家报告分析,且听下回《2019年新兽药研发相关问题研讨会分享(下:技术篇)》分解。
2019年10月30日,以“增强创新技术能力,拓宽行业发展方向”为主题的中国畜牧兽医学会动物药品学分会新兽药研发相关问题研讨会在郑州举行。上篇《2019年新兽药研发相关问题研讨会分享(上:政策篇)》已对谷处的《兽药行业管理政策解读》和董处的《兽药评审新标准新措施介绍》进行了整理和分享。从政策导向和行业发展趋势来看,未来兽药研发、生产和管理主要将围绕“产好药、用好药、少用药”和“禁抗、限抗、替抗”开展,最终目的一切为了健康养殖服务!下面结合此次其他六位专家报告内容,从化药、中兽药及宠物药品三个技术方面进行总结和分析。
1
化 药
此次化药相关内容邀请了行业内知名药学及药理专家华南农业大学曾振灵教授、黄显会教授和中国农业科学院兰州畜牧与兽药研究所李剑勇研究员。自1946年,Moore等首次报道,在饲料中添加抗生素,能明显提高肉鸡的日增重。自此,人们对抗生素的研究和应用越来越广泛。1950年底,美国FDA正式批准在饲料中使用抗生素,并逐渐为世界各国所应用。60多年来,抗生素在动物疾病防治、提高饲料利用率、促进畜禽生长等方面发挥了重要作用,先后有60余种抗生素应用于畜牧养殖业。但随着抗生素的广泛使用,细菌耐药性及药物残留问题日益凸显,自2016年,我国效仿欧盟及美国开始一系列的“减抗、限抗、禁抗”活动。在此背景下,化药(含抗生素)创新显得愈发重要。
华南农业大学曾振灵教授从“3M”方面给大家阐述了未来化药研发的方向。
(一)“me-new”。me-new类药物属于原始创新类药物,需要大量的基础科学研究成果为支撑,包括新的病因学机制的阐明、药物作用靶点的确认以及筛选模型的建立。国外开发一个新兽药的周期大致在10~15年,研发投入1~2亿,当前新型抗生素及抗菌药的发现越来越困难,尤其在畜禽用药方面,欧盟及FDA近些年来开发批准的新兽药很少。
(二)“me-better”。me-better类药物特指具有自主知识产权的药物,其开发风险小、公众认可度高、研发成本相对较低。这类药物其药效和同类的突破性的药物相当,以现有药物为先导物进行研究,避开专利药物的产权保护。如氟喹诺酮类、大环内酯类、头孢菌素类、酰胺醇类及截短侧耳素类兽药的开发,大都基于此理念。目前基于“me-new”和“me-better”理念在我国获批或在研的一类新兽药(化药)有二甲氧苄啶(DVD)、赛拉唑、海南霉素、乙酰甲喹、喹烯酮、维他昔布、沙咪珠利和抗菌肽。这两类新兽药的开发大多由科研机构牵头,并不适合企业开发。
(三)“me-too”。me-too类药物即仿制药(欧盟仿制药的定义;与被仿制药比较,有相同的活性成分,且活性成分的数量相同,有相同的剂型,通过生物等效研究证明等效),无论是仿制原料药(二类新兽药)还是仿制制剂(五类新兽药),其更适合于企业开发,也是当前中国兽药企业最擅长的新兽药开发。me-too类药物衡量的标准:制造成本、产品质量、环境友好。
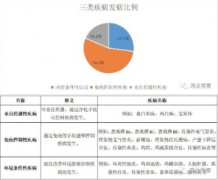
因此,个人觉得在当前几乎“无药可仿”的情况下,比对是一个最好的选择。目前,农业部已出台第一批比对目录(农办医[2016]32号)和第二批比对目录(农业农村部公告第192号)。第一批比对目录共涉及159个品种,其中仅需提供药学研究资料的有79个,有34个产品需要做生物等效试验,有35个产品需要做残留休药期验证。第二批比对目录共涉及112个品种,其中仅需提供药学研究资料的有62个,有21个产品需要做生物等效试验,有18个产品需要做残留休药期验证。目前比对争议较大的在于标准的获取,标准处和质量监督处出于对新兽药知识产权的保护,借鉴欧美国家,不再对新兽药质量标准进行公布,仅限原研单位和监督检查处拥有,且认为比对或仿制仿的是产品而非标准,但按目前比对内容里药学等效的研究要求,质量标准的获取至关重要!
中国农业科学院兰州畜牧与兽药研究所李剑勇研究员围绕“限抗、减抗环境下抗生素类新兽药研发思路”,从加快新型动物专用抗生素兽药研制、新制剂研究、基于增效减量的合理用药三个方面进行了相关内容介绍。
(一)加快新型动物专用抗生素兽药研制。由于创新药物研发难度大,目前主要基于模拟创新药物的研发思路,设计相关先导化合物。如基于构效关系截短侧耳素类结构改造;基于前药原理结构改造(前药,泛指一类体外活性较小或无活性,在体内经酶或非酶作用,释放活性物质而发挥药理作用的化合物);基于双作用机制结构改造;基于代谢研究结构改造;基于药物的配伍作用改造。
(二)新制剂研究。1、复方制剂的开发。包括:扩大抗菌谱,增强抗菌效力(不同抗菌谱及抗菌作用机制药物联合);抑制耐药酶,恢复抗菌效力;阻断细菌感染途径,提高抗菌效果;抗病原细菌,抑制炎症,促进疾病恢复。(2)基于新剂型的制剂研究。包括:缓控释制剂(原位凝胶给药技术、缓释微球)、靶向制剂、固体分散体制剂(介孔二氧化硅固体分散体技术);纳米制剂;混悬制剂;微型胶囊。
(三)基于增效减量的合理用药。包括抗生素最佳剂量再确认(PK/PD模型、PPK(群体药物动力学)、PBPK(生理药代动力学)、剂量筛选确认试验)和联合用药(抗生素+抗生素、+增效剂; +中药;+生物制剂)。
华南农业大学黄显会教授做了题为《兽用化药制剂工艺创新》,此报告真正从临床一线用药出发和思考,针对当前养殖中不可回避的问题,围绕兽药创新的三个基本要素(临床药效作用最大化、关注食品安全热点、服务指导客户合理使用产品)给出了兽用化药创新的发展方向。首先,什么是“好药”?安全、有效、质量可控、使用方便、成本低。什么是“创新”?制剂创新不是非法添加,不能满足质量标准检测是不被接受的,规范化是企业的发展之路,任何创新都不能超越红线。什么是“药物临床需求”?治防用药和治疗用药。
(一)兽药创新的基本要素之一临床药效作用最大化。所谓临床药效作用最大化,就要达到生物利用度最大化,药物的毒副作用最小化,未病先防和既病防变。要想实现这一目标,药物剂型和制剂工艺创新是关键。针对内服混饲型药物,微囊化制剂工艺是当前创新的热点。微囊化制剂的优点是可以实现缓释、掩味、同步释放、液体药物固体化、过胃肠溶定位释放。微囊化制剂的主要实施手段有2种,一种是包被型,一种是骨架型(又称镶嵌型)。黄老师在微囊型制剂方面造诣很深,其经典的几个实施案例微囊化缓释型氟苯尼考预混剂、微囊化同步释放的复方磺胺间甲氧嘧啶预混剂、微囊化过胃肠溶复方伊维菌素阿苯达唑预混剂、增溶缓释颗粒型金霉素预混剂等产品,设计理念新颖,临床效果好,通过制剂工艺创新赋予了老药新的生命活力!针对注射给药制剂。从养殖场的需求出发(使用方便性和临床效果确实),首选长效制剂。针对饮水给药制剂设计。要关注药物的溶解性、药物的稳定性、给药方式和给药剂量、药物的有效浓度。目前临床集约化养殖饮水管线给药通常是推荐使用的1:50~100倍。
(二)兽药创新的基本要素之二关注食品安全热点。尤其是兽药残留。大多数植物提取物都有促生长的作用,其作用机理主要包括体内抗氧化,增强机体免疫,提高抵抗力;抗炎作用、促进肠道健康,促进全身康复;轻微抗菌作用,促进抗菌药的临床效果。但缺陷是资源有限,临床使用成本高和天然物质溶解性差。提高活性物质的生物利用度是提高植物提取物临床应用的关键。如分子微囊化的姜黄素颗粒和水飞蓟素增溶颗粒。
(三)兽药创新的基本要素之三服务指导客户合理使用产品。包括以客户为上、为客户建立良好的用药理念;建立良好的药房制度;建立良好的用药方案。健康养殖不是无抗养殖,未来化药创新方向:API创制(植物源性功能单体的合成与修饰);化学药物制剂工艺的创新(微囊化、包合物和纳米乳)、健康养殖类产品制剂工艺的创新(解决天然物质溶解性差、作用机制研究)。
目前在制剂工艺创新方面有一定争议,就是现行的兽药分类及质量标准和GMP生产工艺要求限制了兽药制剂的创新,未来国家应该鼓励和研究制定适合制剂创新的相关匹配政策,真正实现“好兽药,中国造”的梦想!
中 药
此次中药相关内容邀请了中国兽医药品监察所巩忠福处长和南京农业大学胡元亮教授。
巩处首先介绍了中兽药产业及研发现状:
(一)中兽药产业正在发展壮大。初步具备自主研究开发能力,2004年前农业部批准中兽药新品种不超过10个,2004年以来,受理注册500项,批准超过100个,12年后每年获批10个左右;
(二)中兽药研发越来越受到重视。产学研一体化的机制已经形成,联合申报成为主要方式,超过70%。各种渠道经费投入增加,强度加大。企业对新产品、新技术的需求愿望增强,新产品注册明显增加,2015年受理量近100件。
(三)产业整体水平有提高。2017年中药企业实现产值41.43亿,2000年前仅为几千万。中药部分产值超过亿元的企业至少3-5家。
(四)与生物制品和化药相比还有很大差距。产业集中度低,龙头优势不明显。产品同质化、低水平竞争依然严重。
(五)中兽药产业的机遇与挑战。全面减抗成为未来趋势。除中药外停止促生长类抗生素,药添字成为历史。加大产业集中度,3年增加10个百分点,5年增加20~30个百分点。
未来中兽药的研发方向要发挥中兽药的资源优势、理论优势和配伍优势。正确定位,有限替抗!扬长避短,精准发力,抢占宠物市场(老年病、代谢病、机能性疾病)和高端市场。
南京农业大学胡元亮教授从药材创新、处方创新、制法创新为传统中兽医药研发方向指明了方向。
(一)药材创新。发现新药材(如紫锥菊、紫锥菊根、黄连须、太子参须);改造老药材(富硒技术、中药发酵);发现有效成分(青蒿素、黄芪多糖、博落回提取物、香菇多糖等);改造有效成分(多糖硫酸化、多糖硒化,如芪霍散和茯苓多糖散)。
(二)处方创新(创立新处方和改造老处方)。创立新处方包括自创新处方(按君臣佐使组方,通过临床效果和成本确定自拟处方)、借鉴人用中药创新药物发现经验、移植人用方剂、从《饲料原料目录》中选方。改造老处方包括添加微生态制剂和方剂积极其药渣发酵。
(三)制法创新。包括研究新制法和引入新技术。目前散剂的新制法有超微粉(如黄连解毒微粉)和浸膏粉(如香菇多糖粉)。中药新技术如脂质体技术和微囊技术。
中兽药的应用方向主要针对减抗替抗、增强免疫、常见多发疾病(尤其是畜禽脾胃证、肺经病症,宠物心、肝、肾经病症)和新发病(如非瘟)。中兽药创新发展也存在一些与法规冲突的地方。比如中药发酵微生物限度问题,药食同源饲用植物原料的随意组方冲击了新兽药的研发。饲用植物原料的定位是原料而不是药,且企业标准门槛低,监管松!随意的在临床终端组方应用,又将会成为中兽药造假的温床,最终损害的依然是中兽药!
宠物药
中国兽医药品监察所的徐士新处长做了题为《宠物保健药物市场与机会》的报告。
根据《2019年中国宠物行业白皮书》(消费报告),2019年全国城镇宠物犬猫数量9915万只,消费市场规模达到2024亿。在整个消费细分领域,宠物食品消费占比最高,达61.4%。其中宠物零食(8.0%)和宠物药品(4.0%)是消费最快的两个品类,根据预估宠物医疗市场大概300~400亿左右,宠物药品大约在100亿左右(非官方数据)。目前国内宠物用药现状:院内用药基本来自人用药品和走私、进口宠物药品。院外用药主要以外用驱虫药为主,保健药品基本为空白,生物制品多于化学药品,国内产品取得一定进展。当前食品动物市场需求已基本满足,抗生素市场维持在130亿左右,随着国家“减抗、限抗、替抗”政策的实施和推行,未来食品动物用抗生素总量会呈现下滑趋势。因此,发展宠物用药有着广阔的前景与优势:
1、人口老龄化、住房宽大化和年轻人丁克化,宠物成为人们的忠实陪伴;
2、宠物主人愿意花钱给宠物治病、防病;
3、国家对宠物用药的发展有鼓励政策;
4、宠物用化药种类更加广泛,疫苗种类相对较少;
5、宠物用药研发相对简单,研发费用低,时间短,见效快;
6、食品动物用药研发积累的经验和人员积累;
7、宠物用药的利润可观。
相比于畜禽用药,国际上批准了很多宠物用新兽药,使得企业开发的选择余地多。涉及的药品剂型丰富,包括咀嚼片、片剂、糊剂、颗粒剂、溶液剂、软膏、滴剂、透皮剂、喷雾剂、输液、注射剂和麻醉剂等。围绕宠物用药需求,主要包括传染性疾病、寄生虫病和其他疾病(心脏病、肿瘤、肝肾功能不全等)开展相关宠物用品的开发。
未来5年,中国宠物药品会有一个很大的增长期望。不过,目前宠物市场,尤其是宠物最大的驱虫药和疫苗市场,基本上被外资垄断(勃林格、硕腾、拜耳),企业应该避开在驱虫药和疫苗领域与外资竞争,开发一些相对小众的宠物专用新兽药产品或仿制国外驱虫药品,通过质优价廉与外资竞争。另一方面限制当前宠物药品开发的就是GCP临床试验基地。目前能开展宠物临床试验的只有中国农大和华中农大,高昂的临床试验费用也使得很多企业望而却步!